• Các nhiễm trùng cơ hội và nghiêm trọng [xem phần Cảnh báo và thận trọng].
• Xuất huyết [xem phần Cảnh báo và thận trọng].
• Giảm tế bào [xem phần Cảnh báo và thận trọng].
• Bệnh lý ác tính nguyên phát thứ hai [xem phần Cảnh báo và thận trọng].
• Rung nhĩ và cuồng động nhĩ [xem phần Cảnh báo và thận trọng].
Kinh nghiệm trong các thử nghiệm lâm sàng
Do các thử nghiệm lâm sàng được thực hiện trong các điều kiện khác nhau, tỷ lệ các phản ứng ngoại ý được ghi nhận trong các thử nghiệm lâm sàng của một thuốc không thể so sánh trực tiếp với tỷ lệ trong các thử nghiệm lâm sàng của thuốc khác và có thể không phản ánh tỷ lệ quan sát được trong thực tế.
Dữ liệu trong phần Cảnh báo và thận trọng đã phản ánh sự tiếp xúc với CALQUENCE liều 100 mg mỗi 12 giờ trên 1.029 bệnh nhân có bệnh lý huyết học ác tính. Có 6 thử nghiệm trên 820 bệnh nhân sử dụng CALQUENCE đơn trị liệu và 2 thử nghiệm trên 209 bệnh nhân sử dụng CALQUENCE cùng với obinutuzumab. Trong số những bệnh nhân được điều trị bằng CALQUENCE, 88% có tiếp xúc trong ít nhất 6 tháng và 79% tiếp xúc trong ít nhất một năm. Trong dữ liệu an toàn tổng hợp từ các quần thể bệnh nhân này, các phản ứng ngoại ý xảy ra ở ≥ 30% trong tổng số 1.029 bệnh nhân là thiếu máu, giảm bạch cầu trung tính, nhiễm trùng đường hô hấp trên, giảm tiểu cầu, đau đầu, tiêu chảy và đau cơ xương.
U lympho tế bào vỏ
Dữ liệu an toàn được mô tả trong phần này đã phản ánh sự tiếp xúc với CALQUENCE (liều 100 mg mỗi 12 giờ) ở 124 bệnh nhân MCL đã được điều trị trước đây trong thử nghiệm LY-004 [xem phần Dược lý, Các nghiên cứu lâm sàng]. Trung vị thời gian điều trị CALQUENCE là 16,6 tháng (dao động từ 0,1-26,6 tháng). Tổng cộng 91 (73,4%) bệnh nhân được điều trị bằng CALQUENCE trong ít nhất 6 tháng và 74 (59,7%) bệnh nhân được điều trị ≥ 1 năm.
Các phản ứng ngoại ý thường gặp nhất (≥ 20%) ở mọi cấp độ bao gồm thiếu máu, giảm tiểu cầu, đau đầu, giảm bạch cầu trung tính, tiêu chảy, mệt mỏi, đau cơ và bầm tím. Các biến cố thường gặp nhất ngoài huyết học ở cấp độ nghiêm trọng 1 gồm có: nhức đầu (25%), tiêu chảy (16%), mệt mỏi (20%), đau cơ (15%) và bầm tím (19%). Phản ứng ngoại ý ngoài huyết học độ 3 thường gặp nhất (được báo cáo ở ít nhất 2% số bệnh nhân) là tiêu chảy.
Giảm liều và ngừng thuốc do phản ứng ngoại ý đã được báo cáo lần lượt trên 1,6% và 6,5% số bệnh nhân.
Bảng 7 và 8 trình bày phân loại theo tần suất ghi nhận các phản ứng ngoại ý quan sát được trên bệnh nhân MCL được điều trị bằng CALQUENCE.
- xem Bảng 7 & 8.


Tăng creatinin từ 1,5 đến 3 giới hạn trên bình thường xảy ra trên 4,8% số bệnh nhân.
Bệnh bạch cầu mạn dòng lympho
Dữ liệu an toàn được mô tả dưới đây phản ánh sự tiếp xúc CALQUENCE (liều 100 mg mỗi 12 giờ, có hoặc không phối hợp với obinutuzumab) ở 511 bệnh nhân CLL từ hai thử nghiệm lâm sàng ngẫu nhiên có kiểm soát [xem phần Dược lý, Các nghiên cứu lâm sàng].
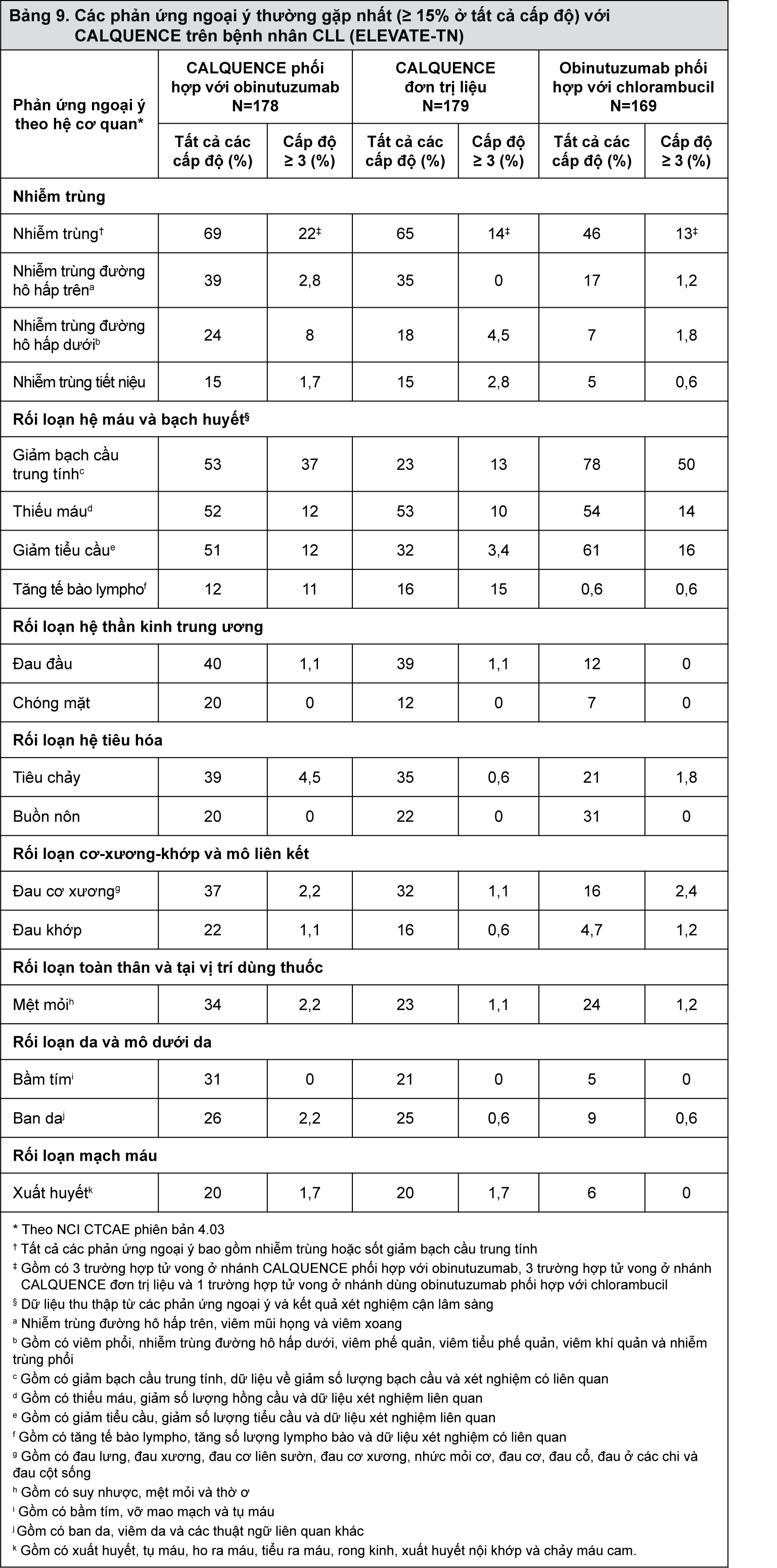
Các phản ứng ngoại ý thường gặp nhất (≥ 30%) ở tất cả cấp độ trên bệnh nhân CLL gồm có thiếu máu, giảm bạch cầu trung tính, giảm tiểu cầu, đau đầu, nhiễm trùng đường hô hấp trên và tiêu chảy.
Nghiên cứu ELEVATE-TN
Tính an toàn của CALQUENCE khi phối hợp với obinutuzumab (CALQUENCE+G), CALQUENCE đơn trị liệu và obinutuzumab phối hợp với chlorambucil (GClb) đã được đánh giá trong một thử nghiệm có đối chứng với thuốc (có hoạt chất), ngẫu nhiên, đa trung tâm, nhãn mở trên 526 bệnh nhân CLL chưa được điều trị trước đây [xem phần Dược lý, Các nghiên cứu lâm sàng].
Bệnh nhân được phân ngẫu nhiên vào nhánh dùng phác đồ CALQUENCE+G đã được điều trị bằng CALQUENCE phối hợp với obinutuzumab trong sáu chu kỳ, sau đó dùng CALQUENCE đơn trị liệu cho đến khi bệnh tiến triển hoặc xuất hiện độc tính không thể dung nạp được. Nhóm bệnh nhân này khởi đầu điều trị với obinutuzumab vào ngày 1 của chu kỳ 2, tiếp tục toàn bộ 6 chu kỳ. Bệnh nhân được điều trị ngẫu nhiên bằng CALQUENCE đơn trị liệu dùng thuốc mỗi 12 giờ cho đến khi bệnh tiến triển hoặc xuất hiện độc tính không thể dung nạp được. Thử nghiệm yêu cầu người tham gia có tuổi ≥ 65 tuổi hoặc từ 18 đến < 65 tuổi với tổng điểm theo Thang đánh giá bệnh tích lũy (CIRS) > 6 hoặc độ thanh thải creatinin từ 30 đến 69 mL/phút, transaminase gan ≤ 3 lần giới hạn trên bình thường (ULN) và bilirubin toàn phần ≤ 1,5 lần ULN, và cho phép bệnh nhân được dùng các thuốc chống huyết khối khác với warfarin hoặc các chất kháng vitamin K tương tự.
Trong quá trình được điều trị ngẫu nhiên, thời gian trung vị tiếp xúc với CALQUENCE ở nhánh CALQUENCE+G và CALQUENCE đơn trị liệu là 27,7 tháng (dao động từ 0,3 đến 40 tháng), với tỷ lệ bệnh nhân dùng thuốc của mỗi nhánh trong ít nhất 6 tháng lần lượt là 95% và 92% và ít nhất trong 12 tháng lần lượt là 89% và 86%. Ở nhánh dùng obinutuzumab và chlorambucil, trung vị số chu kỳ là 6 với 84% bệnh nhân được điều trị obinutuzumab ít nhất 6 chu kỳ, 70% bệnh nhân điều trị chlorambucil ít nhất 6 chu kỳ. 85% bệnh nhân ở nhánh CALQUENCE+G được điều trị bằng obinutuzumab trong ít nhất 6 chu kỳ.
Ở nhánh sử dụng CALQUENCE+G và CALQUENCE đơn trị liệu, ghi nhận 2% các phản ứng gây tử vong trong khi bệnh không tiến triển và khởi phát trong vòng 30 ngày kể từ lần dùng thuốc cuối cùng trong nghiên cứu ở mỗi nhánh điều trị, thường là do nhiễm trùng. Ghi nhận 39% bệnh nhân có phản ứng ngoại ý nghiêm trọng ở nhánh CALQUENCE+G và 32% ở nhánh CALQUENCE đơn trị liệu, thường gặp nhất liên quan đến các biến cố về viêm phổi (từ 2,8% đến 7%).
Trong nhánh CALQUENCE+G, 11% số bệnh nhân phải ngừng điều trị và 7% phải giảm liều CALQUENCE do phản ứng ngoại ý. Ở nhánh dùng CALQUENCE đơn trị liệu, phản ứng ngoại ý gây ngừng điều trị ở 10% số bệnh nhân và giảm liều ở 4% bệnh nhân.
Bảng 9 và 10 mô tả các phản ứng ngoại ý và các tham số xét nghiệm cận lâm sàng bất thường được xác định trong thử nghiệm ELEVATE-TN.
- xem Bảng 9.
Các phản ứng ngoại ý có ý nghĩa lâm sàng khác (tỷ lệ xảy ra ở tất cả cấp độ < 15%) trên bệnh nhân sử dụng CALQUENCE (đơn trị liệu hoặc phối hợp với obinutuzumab) bao gồm:
• Ung thư: bệnh lý ác tính nguyên phát thứ hai (10%), ung thư tế bào da không sắc tố (5%)
• Rối loạn trên tim: rung nhĩ hoặc cuồng động nhĩ (3,6%), tăng huyết áp (5%)
• Nhiễm trùng: nhiễm virus herpes (6%).
- xem Bảng 10.

Nồng độ creatinin tăng gấp 1,5 đến 3 lần giới hạn trên bình thường ghi nhận ở 3,9% bệnh nhân ở nhánh dùng CALQUENCE phối hợp và 2,8% ở nhánh đơn trị liệu.
Nghiên cứu ASCEND
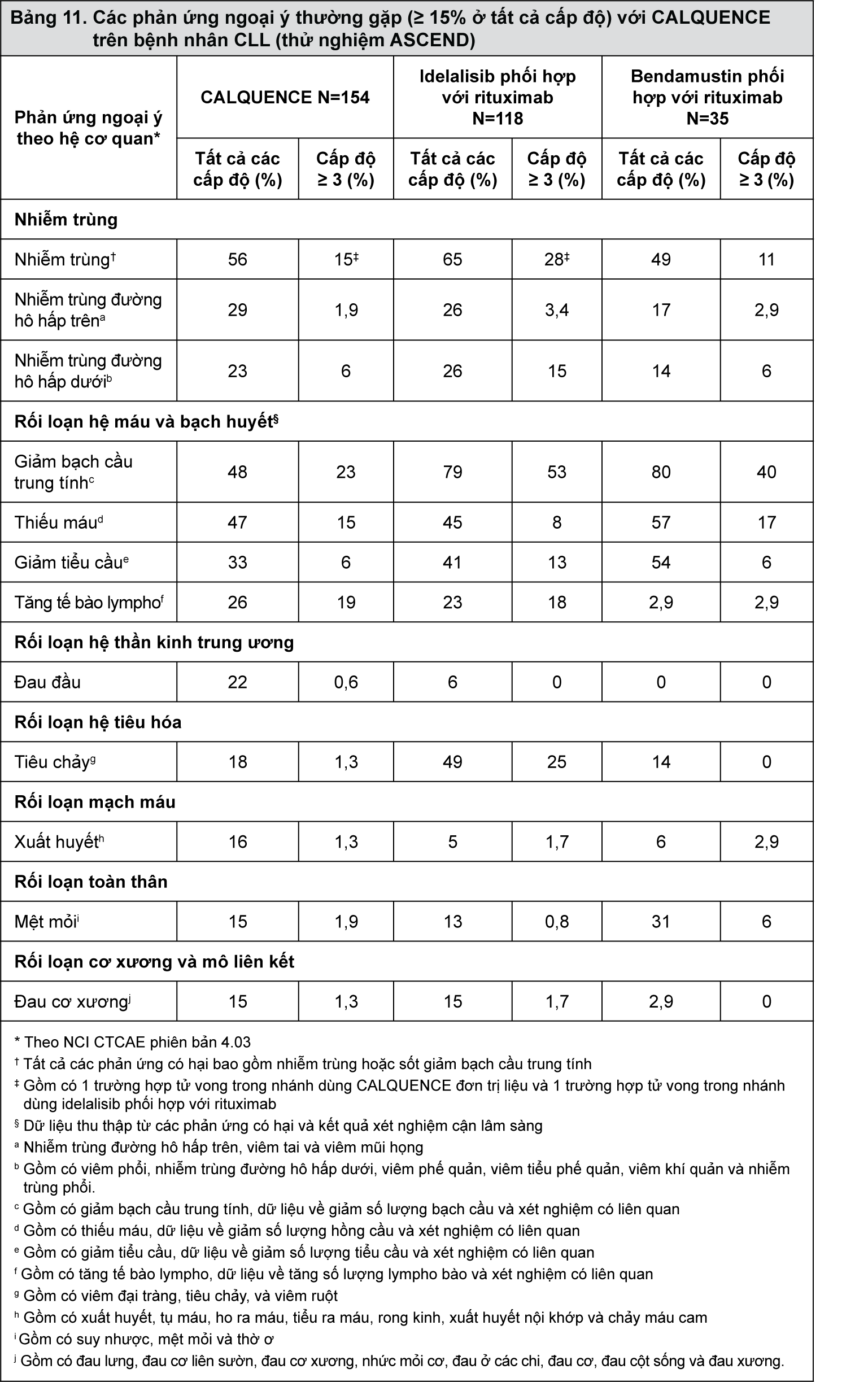
Tính an toàn của CALQUENCE ở những bệnh nhân CLL tái phát hoặc kháng trị đã được đánh giá trong một thử nghiệm ngẫu nhiên, nhãn mở (ASCEND) [xem phần Dược lý, Các nghiên cứu lâm sàng]. Thử nghiệm thu nhận các bệnh nhân CLL tái phát hoặc kháng trị đã điều trị ít nhất một liệu pháp trước đây và yêu cầu transaminase gan không vượt quá 2 lần giới hạn bình thường trên (ULN), bilirubin toàn phần ≤ 1,5 lần ULN và độ thanh thải creatinin ước tính ≥ 30 mL/phút. Thử nghiệm đã loại trừ những bệnh nhân có số lượng tế bào bạch cầu trung tính < 500/μL, số lượng tiểu cầu < 30.000/μL, thời gian prothrombin hoặc thời gian hoạt hóa thromboplastin từng phần > 2 lần ULN, có bệnh lý tim mạch rõ ràng hoặc cần sử dụng các thuốc ức chế hoặc cảm ứng mạnh CYP3A. Bệnh nhân được dùng các thuốc chống huyết khối trừ warfarin hoặc các chất kháng vitamin K tương tự.
Trong thử nghiệm ASCEND, 154 bệnh nhân đã dùng CALQUENCE (liều 100 mg mỗi 12 giờ cho đến khi bệnh tiến triển hoặc xuất hiện độc tính không thể dung nạp được), 118 bệnh nhân đã dùng idelalisib (liều 150 mg mỗi 12 giờ cho đến khi bệnh tiến triển hoặc xuất hiện độc tính không thể dung nạp được) với tối đa 8 lần truyền tĩnh mạch rituximab và 35 bệnh nhân được điều trị với 6 chu kỳ bendamustin và rituximab. Tuổi trung vị toàn bộ bệnh nhân nghiên cứu là 68 tuổi (dao động từ 32 đến 90 tuổi); 67% là nam giới; 92% là người da trắng và 88% có điểm đánh giá thể trạng ECOG là 0 hoặc 1.
Trong nhánh sử dụng CALQUENCE, các phản ứng ngoại ý nghiêm trọng xảy ra ở 29% bệnh nhân. Một số phản ứng ngoại ý nghiêm trọng ghi nhận > 5% bệnh nhân sử dụng CALQUENCE, trong đó có nhiễm trùng đường hô hấp dưới (6%). 2,6% bệnh nhân có phản ứng ngoại ý tử vong ghi nhận trong vòng 30 ngày kể từ liều dùng CALQUENCE cuối cùng trong nghiên cứu, bao gồm cả các bệnh lý ác tính nguyên phát thứ hai và nhiễm trùng.
Ở những người sử dụng CALQUENCE, ghi nhận 10% bệnh nhân ngừng thuốc vĩnh viễn do phản ứng ngoại ý, thường gặp nhất là do các bệnh lý ác tính nguyên phát thứ hai, kế đến là nhiễm trùng. 34% bệnh nhân có các phản ứng ngoại ý làm gián đoạn điều trị CALQUENCE, thường gặp nhất là do nhiễm trùng đường hô hấp, tiếp đến là giảm bạch cầu trung tính và 3,9% bệnh nhân phải giảm liều.
Các phản ứng ngoại ý được mô tả chọn lọc trong Bảng 11 và các tham số xét nghiệm cận lâm sàng bất thường ngoài huyết học được mô tả trong Bảng 12. Những bảng này đã phản ánh sự tiếp xúc với CALQUENCE với trung vị thời gian là 15,7 tháng, trong đó có 94% bệnh nhân được điều trị hơn 6 tháng và 86% bệnh nhân điều trị hơn 12 tháng. Trung vị thời gian tiếp xúc với idelalisib là 11,5 tháng với 72% số bệnh nhân đang điều trị hơn 6 tháng và 48% bệnh nhân đang điều trị hơn 12 tháng. 83% bệnh nhân đã hoàn thành 6 chu kỳ với các chế phẩm có bendamustin và rituximab.
- xem Bảng 11.
Các phản ứng ngoại ý có ý nghĩa trên lâm sàng khác (với tỷ lệ phản ứng ở tất cả cấp độ < 15%) ở bệnh nhân sử dụng CALQUENCE bao gồm:
• Rối loạn da và mô dưới da: bầm tím (10%), ban da (9%)
• Ung thư: bệnh lý ác tính nguyên phát thứ hai (12%), ung thư tế bào da không sắc tố (6%)
• Rối loạn cơ xương và mô liên kết: đau khớp (8%)
• Rối loạn trên tim: rung nhĩ hoặc cuồng động nhĩ (5%), tăng huyết áp (3,2%)
• Nhiễm trùng: nhiễm virus herpes (4,5%)
- xem Bảng 12.

Nồng độ creatinin tăng từ 1,5 đến 3 lần ULN được ghi nhận ở 1,3% bệnh nhân dùng CALQUENCE.
View ADR Monitoring Form




 Đăng xuất
Đăng xuất



