Đặc tính dược lực học
Nhóm dược lý trị liệu: Ức chế kết tập tiểu cầu không gồm heparin, mã ATC: B01AC24
Cơ chế tác động
BRILINTA chứa ticagrelor, một thành phần của nhóm hóa học cyclopentyltriazolopyrimidin (CPTP), một thuốc dạng uống, có tác động trực tiếp, ức chế chọn lọc và có hồi phục thụ thể P2Y
12, ngăn cản quá trình hoạt hóa và kết tập tiểu cầu phụ thuộc P2Y
12 qua trung gian ADP adenosin diphosphat. Ticagrelor không ngăn cản ADP gắn kết với thụ thể P2Y
12, nhưng khi Ticagrelor gắn với thụ thể P2Y
12 sẽ ngăn chặn việc dẫn truyền tín hiệu cảm ứng ADP. Vì tiểu cầu tham gia vào quá trình khởi phát và/hoặc phát triển các biến chứng huyết khối của bệnh xơ vữa động mạch, việc ức chế chức năng tiểu cầu đã được chứng minh là làm giảm nguy cơ tai biến tim mạch như tử vong, nhồi máu cơ tim hoặc đột quỵ.
Ticagrelor, cũng làm tăng nồng độ adenosin nội sinh tại chỗ bằng cách ức chế chất vận chuyển cân bằng nucleoside -1 (ENT-1).
Ticagrelor đã được ghi nhận là làm tăng tác động cảm ứng adenosin sau đây ở người khỏe mạnh và bệnh nhân ACS: giãn mạch (xác định bằng cách tăng lưu lượng máu mạch vành ở người tình nguyện khỏe mạnh và bệnh nhân ACS; đau đầu), ức chế chức năng tiểu cầu (máu toàn phần của người khi quan sát trong phòng thí nghiệm) và khó thở. Tuy nhiên, mối liên hệ giữa các ca ghi nhận tăng adenosin và kết quả lâm sàng (ví dụ: tỷ lệ mắc bệnh- tử vong) chưa được làm sáng tỏ rõ ràng.
Tác động dược lực học
Khởi phát tác động
Trên những bệnh nhân bị bệnh động mạch vành ổn định sử dụng ASA, ticagrelor cho thấy khởi phát nhanh tác động dược lý với khả năng ức chế kết tập tiểu cầu (IPA) trung bình ở nhóm dùng ticagrelor sau 0,5 giờ sử dụng liều nạp 180 mg vào khoảng 41%, hiệu quả ức chế kết tập tiểu cầu (IPA) tối đa là 89% sau khi dùng thuốc 2-4 giờ và duy trì tiếp 2-8 giờ. 90% bệnh nhân có mức độ ức chế kết tập tiểu cầu (IPA) cuối cùng là >70% sau hai giờ dùng thuốc.
Tác động tồn dư
Nếu có kế hoạch phẫu thuật bắc cầu mạch vành, có tăng nguy cơ xuất huyết so với clopidogrel nếu ngưng dùng ticagrelor chưa đủ 96 giờ trước khi tiến hành phẫu thuật.
Dữ liệu về chuyển đổi thuốc
Việc chuyển từ clopidogrel sang dùng ticagrelor làm tăng 26,4% sự ức chế kết tập tiểu cầu (IPA) và chuyển từ ticagrelor sang dùng clopidogrel làm giảm 24,5% sự ức chế kết tập tiểu cầu (IPA). Bệnh nhân có thể chuyển từ clopidogrel sang dùng ticagrelor mà không bị gián đoạn hiệu quả kháng tiểu cầu (xem phần
Liều lượng và Cách dùng).
Hiệu quả và an toàn trên lâm sàng
Các bằng chứng lâm sàng về hiệu quả và an toàn của ticagrelor được trích từ 2 nghiên cứu lâm sàng pha 3:
- Nghiên cứu PLATO [PLATelet Inhibition and Patient Outcomes], ticagrelor so với clopidogrel, cả hai đều kết hợp với ASA và liệu pháp điều trị chuẩn khác.
- Nghiên cứu PEGASUS TIMI 54 [PrEvention with TicaGrelor of SecondAry Thrombotic Events in High RiSk AcUte Coronary Syndrome Patients], ticagrelor kết hợp với ASA so với liệu pháp điều trị ASA đơn thuần.
Nghiên cứu PLATO (Hội chứng mạch vành cấp)
Nghiên cứu PLATO được thực hiện trên 18.624 bệnh nhân có triệu chứng của đau thắt ngực không ổn định (UA) trong vòng 24 giờ, nhồi máu cơ tim không có ST chênh lên (NSTEMI) hoặc nhồi máu cơ tim có ST chênh lên (STEMI) và đã bắt đầu điều trị nội khoa, hoặc có can thiệp mạch vành qua da (PCI), hoặc phẫu thuật bắc cầu mạch vành (CABG).
Hiệu quả lâm sàng
Trên nền điều trị ASA hằng ngày, dùng ticagrelor liều 90mg hai lần mỗi ngày cho thấy hiệu quả vượt trội hơn sử dụng clopidogrel liều 75 mg mỗi ngày trên tiêu chí chính bao gồm tử vong tim mạch [CV], nhồi máu cơ tim [MI] hoặc đột quỵ, với sự khác biệt rõ rệt về tiêu chí tử vong tim mạch và nhồi máu cơ tim. Bệnh nhân sử dụng liều nạp 300 mg clopidogrel (có thể lên đến 600mg nếu có can thiệp mạch vành qua da (PCI)) hoặc 180 mg ticagrelor.
Kết quả nghiên cứu đến sớm (giảm 0,6% nguy cơ tuyệt đối [absolute risk reduction-ARR] và giảm 12% nguy cơ tương đối [Relative risk reduction-RRR] sau 30 ngày) với hiệu quả điều trị hằng định suốt 12 tháng, tính theo ARR là 1,9% mỗi năm và RRR là 16%. Kết quả cho thấy thời gian điều trị bằng ticagrelor cho bệnh nhân có thể lên đến 12 tháng (xem phần
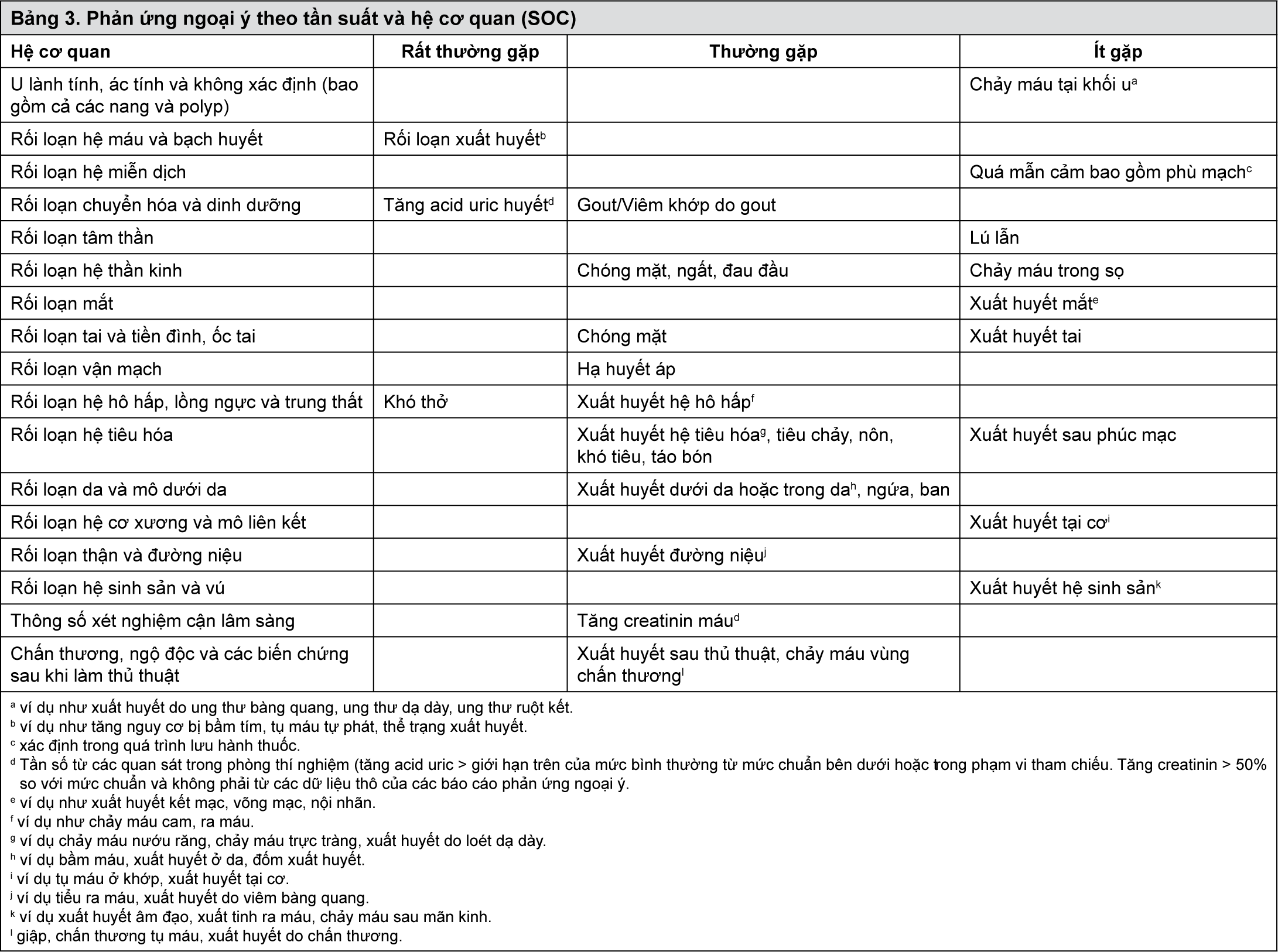
Liều lượng và Cách dùng). Điều trị cho 54 bệnh nhân bị Hội Chứng Mạch Vành Cấp bằng ticagrelor thay vì clopidogrel sẽ ngăn ngừa 1 biến cố huyết khối xơ vữa động mạch, điều trị cho 91 bệnh nhân giúp ngăn ngừa 1 trường hợp tử vong tim mạch (xem Biểu đồ 1 và Bảng 1).
Hiệu quả điều trị của ticagrelor cao hơn clopidogrel nhất quán trên nhiều phân nhóm bệnh nhân phân loại theo cân nặng, giới tính, tiền sử bị bệnh đái tháo đường, có cơn thiếu máu não thoáng qua hoặc đột quỵ không xuất huyết, hoặc tái thông mạch máu; các trị liệu phối hợp thuốc với heparin, chất ức chế GpIIb/IIIa và ức chế bơm proton (xem phần
Tương Tác), chỉ số dự đoán biến cố cuối cùng (STEMI, NSTEMI hoặc UA); và quá trình điều trị được ấn định khi phân bố ngẫu nhiên bệnh nhân vào nghiên cứu (xâm lấn hoặc dùng thuốc).
Đã ghi nhận có sự tương tác điều trị không đáng kể với vùng nghiên cứu mà tỷ số rủi ro (HR - Harzard Ratio) trên tiêu chí chính có lợi trên nhóm dùng ticagrelor ở hầu hết các vùng nghiên cứu nhưng lại có lợi hơn cho nhóm dùng clopidogrel khi nghiên cứu ở Bắc Mỹ, chiếm tỷ lệ khoảng 10% tổng dân số nghiên cứu (giá trị p = 0,045).
Các phân tích thêm gợi ý khả năng liên quan tới liều dùng ASA như là làm giảm hiệu quả đã được ghi nhận trên nhóm dùng ticagrelor khi tăng liều ASA. Nên dùng liều duy trì hằng ngày ASA là 75-100 mg khi kết hợp với BRILINTA (xem phần
Liều lượng và Cách dùng và
Cảnh báo và Thận trọng).
Biểu đồ 1 trình bày đánh giá nguy cơ xảy ra biến cố đầu tiên trên tiêu chí gộp chung về hiệu quả điều trị.
- xem Biểu đồ 1
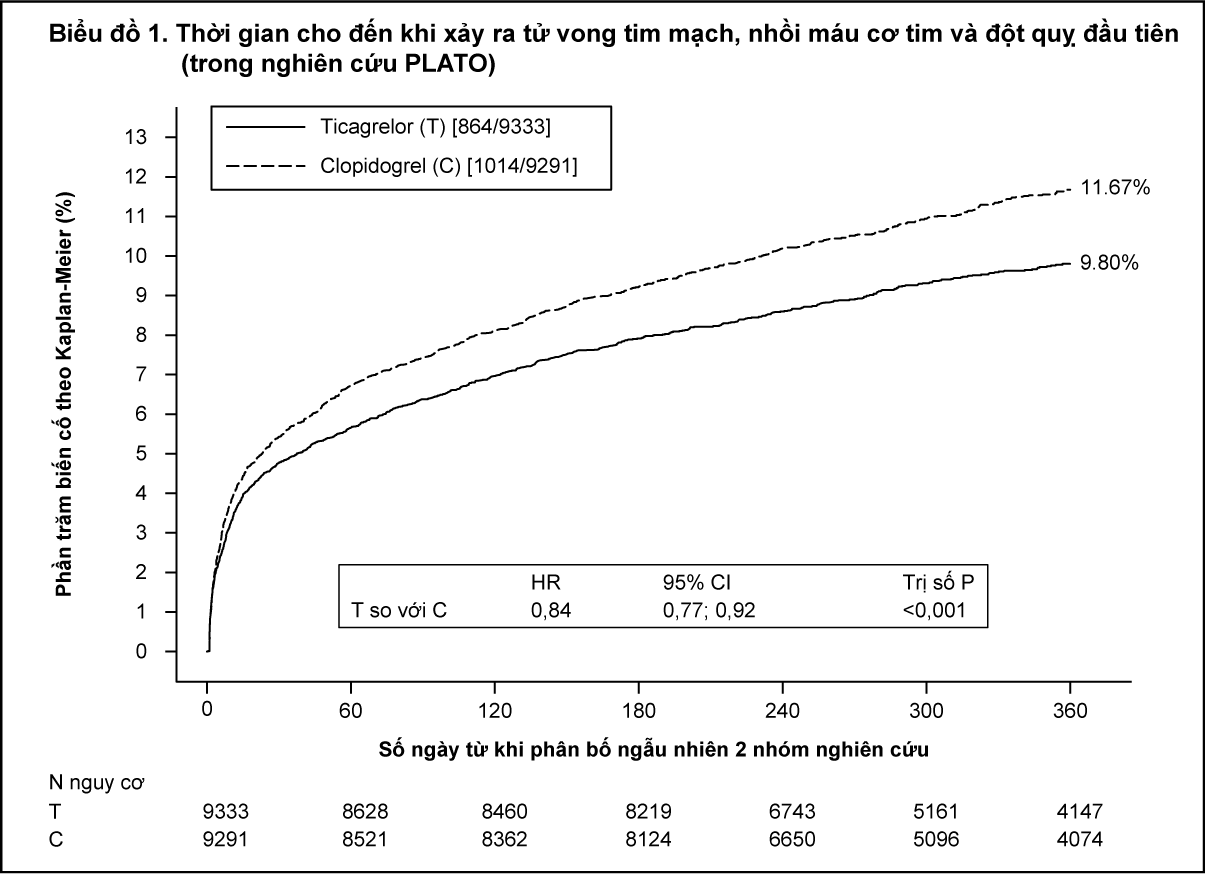
BRILINTA làm giảm tần suất tiêu chí gộp chung chính (primary composite endpoint) so với clopidogrel ở cả nhóm bệnh nhân đau thắt ngực không ổn định (UA)/ nhồi máu cơ tim không có ST chênh lên (NSTEMI) và nhồi máu cơ tim có ST chênh lên (STEMI) (Bảng 1). Vì thế, BRILINTA 90 mg 2 lần mỗi ngày cùng với liều thấp ASA có thể dung ở bệnh nhân ACS (đau thắt ngực không ổn định, nhồi máu cơ tim không có ST chênh lên [NSTEMI] hoặc nhồi máu cơ tim có ST chênh lên [STEMI]; bao gồm các bệnh nhân được điều trị nội khoa, và các bệnh nhân này được can thiệp mạch vành qua da (percutaneous coronary intervention - PCI) hoặc phẫu thuật bắc cầu mạch vành (coronary artery by-pass grafting - CABG).
- xem Bảng 1
 Phân nhóm theo kiểu di truyền trong nghiên cứu PLATO
Phân nhóm theo kiểu di truyền trong nghiên cứu PLATO
Phân tích kiểu gen của CYP2C19 và ABCB1 trên 10.285 bệnh nhân trong nghiên cứu PLATO cho thấy mối liên hệ giữa các nhóm kiểu gen với kết quả nghiên cứu. Sự vượt trội của ticagrelor so với clopidogrel trong việc giảm các biến cố tim mạch chính không bị ảnh hưởng đáng kể bởi kiểu gen CYP2C19 và ABCB1 của bệnh nhân. Tương tự như trên tổng bệnh nhân trong nghiên cứu PLATO, không có sự khác biệt giữa ticagrelor và clopidogrel trên tổng số ca xuất huyết nặng trong nghiên cứu PLATO, bất kể kiểu gen CYP2C19 hoặc ABCB1. Xuất huyết nặng trên phân nhóm bệnh nhân không có phẫu thuật bắc cầu mạch vành (non-CABG) trong nghiên cứu PLATO tăng khi dùng ticagrelor so với clopidogrel ở những bệnh nhân bị mất một hoặc nhiều hơn các alen chức năng quy định CYP2C19, nhưng lại tương tự như clopidogrel ở những bệnh nhân không bị mất alen chức năng.
Tiêu chí kết hợp về hiệu quả và an toàn
Tiêu chí kết hợp về hiệu quả và an toàn (tử vong tim mạch, nhồi máu cơ tim, đột quỵ hoặc tổng số ca xuất huyết nặng theo định nghĩa của nghiên cứu PLATO) cho thấy lợi ích về hiệu quả của BRILINTA so với clopidogrel không bị ảnh hưởng bởi các biến cố xuất huyết nặng (ARR 1,4%, RRR 8%, HR 0,92; p=0,0257) suốt 12 tháng sau Hội Chứng Mạch Vành Cấp.
An toàn lâm sàng
Phân nhóm Holter
Nhằm khảo sát tần suất ngưng xoang và loạn nhịp tim trong nghiên cứu PLATO, các nhà nghiên cứu đã tiến hành theo dõi điện tâm đồ liên tục 24 giờ (Holter) trên một phân nhóm gần 3.000 bệnh nhân, trong đó có khoảng 2.000 bệnh nhân được ghi nhận ở cả giai đoạn cấp của hội chứng mạch vành cấp và sau 1 tháng. Biến số quan tâm đầu tiên là tần suất ngưng xoang ≥ 3 giây. Nhiều bệnh nhân bị ngưng xoang khi sử dụng ticagrelor (6%) hơn so với dùng clopidogrel (3,5%) trong giai đoạn cấp và 2,2% ở nhóm dùng ticagrelor so với 1,6% dùng clopidogrel sau 1 tháng (xem phần
Cảnh báo và Thận trọng). Việc gia tăng ngưng xoang trong giai đoạn cấp của Hội Chứng Mạch Vành Cấp được ghi nhận ở các bệnh nhân dùng ticagrelor có tiền sử bị suy tim sung huyết (9,2% so với 5,4% bệnh nhân không có tiền sử suy tim sung huyết); với bệnh nhân sử dụng clopidogrel, 4% ở bệnh nhân có tiền sử suy tim sung huyết so với 3,6% bệnh nhân không có tiền sử suy tim sung huyết). Sự mất cân bằng này không xuất hiện sau 1 tháng: lần lượt là 2% so với 2,1% trên bệnh nhân sử dụng ticagrelor có và không có tiền sử suy tim sung huyết, 3,8% so với 1,4% ở nhóm bệnh nhân dùng clopidogrel. Không có tác động không mong muốn trên lâm sàng liên quan tới sự mất cân bằng này (ngay cả việc đặt máy tạo nhịp) trên nhóm bệnh nhân nghiên cứu.
PEGASUS study (History of Myocardial Infarction)
Nghiên cứu PEGASUS TIMI 54 là một nghiên cứu đa trung tâm quốc tế, nhóm song song, kiểm chứng bằng giả dược, mù đôi, lựa chọn ngẫu nhiên, dựa theo biến cố xảy ra, tiến hành trên 21.162 bệnh nhân để đánh giá việc dự phòng biến cố huyết khối do xơ vữa động mạch, dùng ticagrelor 2 mức liều (cả 90 mg hai lần mỗi ngày hoặc 60 mg hai lần mỗi ngày) kết hợp với liều thấp ASA (75-150 mg), so với liệu pháp điều trị ASA đơn thuần ở những bệnh nhân có tiền sử nhồi máu cơ tim và có yếu tố nguy cơ huyết khối do xơ vữa động mạch.
Bệnh nhân đủ điều kiện để tham gia nghiên cứu nếu như ≥ 50 tuổi, có tiền sử nhồi máu cơ tim (1-3 năm trước khi được lựa chọn ngẫu nhiên), và đã có ít nhất một trong các yếu tố nguy cơ huyết khối do xơ vữa động mạch: tuổi ≥ 65 tuổi, bệnh đái tháo đường hiện đang điều trị, nhồi máu cơ tim tái phát, có bằng chứng về bệnh nhiều nhánh mạch vành, hoặc rối loạn chức năng thận mãn tính không phải giai đoạn cuối.
Bệnh nhân không đủ điều kiện nếu như có kế hoạch sử dụng thuốc đối kháng thụ thể P2Y
12, dipyridamole, cilostazol, hoặc thuốc chống đông trong thời gian nghiên cứu; nếu bệnh nhân đã có một rối loạn chảy máu hoặc có tiền sử đột quỵ thiếu máu cục bộ hoặc xuất huyết nội sọ, có khối u hệ thống thần kinh trung ương, hay bất thường mạch máu nội sọ; nếu bệnh nhân đã có xuất huyết tiêu hóa trong vòng 6 tháng trước hoặc có đại phẫu trong vòng 30 ngày trước.
Hiệu quả lâm sàng
- xem Biểu đồ 2 & Bảng 2
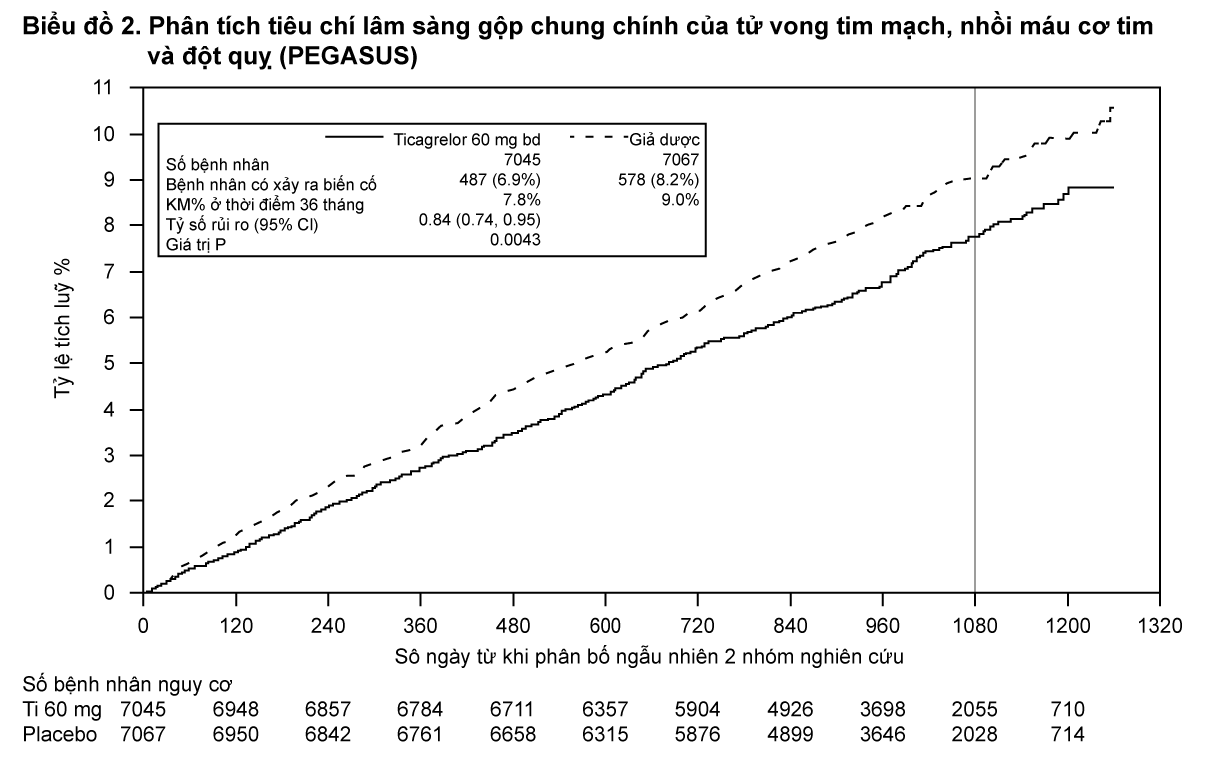

Cả hai phác đồ liều 60 mg hai lần mỗi ngày và 90 mg hai lần mỗi ngày của ticagrelor kết hợp với ASA đều vượt trội so với điều trị bằng ASA đơn thuần trong phòng ngừa các biến cố huyết khối do xơ vữa động mạch (tiêu chí cộng gộp cuối: tử vong tim mạch, nhồi máu cơ tim và đột quỵ), với hiệu quả điều trị thống nhất trong toàn bộ thời gian nghiên cứu, đạt được RRR 16% và 1,27% ARR đối với ticagrelor 60 mg, và RRR 15% và 1,19% ARR đối với ticagrelor 90 mg.
Mặc dù dữ liệu hiệu quả của 90 mg và 60 mg là tương tự nhau, có bằng chứng rằng liều thấp có khả năng dung nạp và an toàn hơn về mặt nguy cơ chảy máu và khó thở. Vì vậy, khuyến khích chỉ dùng BRILINTA 60 mg hai lần mỗi ngày kết hợp với ASA để phòng ngừa biến cố huyết khối do xơ vữa động mạch (tử vong tim mạch, nhồi máu cơ tim và đột quỵ) ở những bệnh nhân có tiền sử nhồi máu cơ tim và có nguy cơ cao tiến triển biến cố huyết khối do xơ vữa dộng mạch.
So với liệu pháp điều trị bằng ASA đơn thuần, ticagrelor 60 mg hai lần mỗi ngày làm giảm đáng kể tiêu chí gộp chung chính của tử vong tim mạch, nhồi máu cơ tim và đột quỵ. Mỗi yếu tố đều đóng góp vào việc giảm tiêu chí gộp chung chính (tử vong tim mạch 17% RRR, nhồi máu cơ tim 16% RRR, và đột quỵ 25% RRR).
Tỷ lệ RRR đối với tiêu chí gộp chung từ ngày 1 đến 360 ngày (17% RRR) và từ 361 ngày trở lên (16% RRR) là tương tự. Dữ liệu về hiệu quả và tính an toàn khi dùng ticagrelor kéo dài hơn 3 năm còn hạn chế.
Không có bằng chứng về lợi ích (không giảm tiêu chí gộp chung chính của tử vong tim mạch, nhồi máu cơ tim và đột quỵ, nhưng sự gia tăng chảy máu nghiêm trọng) khi ticagrelor 60 mg hai lần mỗi ngày được dùng ở những bệnh nhân ổn định về mặt lâm sàng > 2 năm kể từ khi nhồi máu cơ tim hoặc nhiều hơn một năm sau khi ngừng điều trị thuốc ức chế thụ thể ADP trước (xem phần
Liều lượng và cách dùng).
An toàn trên lâm sàng
Tỷ lệ ngưng thuốc ticagrelor 60 mg do chảy máu và khó thở cao hơn ở bệnh nhân > 75 tuổi (42%) so với bệnh nhân trẻ tuổi (từ 23-31%), khác biệt so với giả dược cao hơn 10% (42% so với 29%) ở bệnh nhân > 75 tuổi.
Đối tượng trẻ em
Cơ quan Quản lý Thuốc Châu Âu đã miễn trừ việc bắt buộc nộp các kết quả nghiên cứu về BRILINTA trên tất cả các phân nhóm trẻ em trong chỉ định được phê duyệt (xem
Liều lượng và Cách dùng và
Dược lý - Đặc tính dược động học).
Đặc tính dược động học
Ticagrelor cho thấy dược động học tuyến tính. Nồng độ và thời gian tiếp xúc với ticagrelor và chất chuyển hóa có hoạt tính (AR C124910XX) tỷ lệ theo liều lên đến khoảng 1.260 mg.
Hấp thu
Ticagrelor hấp thu nhanh với t
max trung bình khoảng 1,5 giờ. Chất chuyển hóa chính tuần hoàn trong máu AR-C124910XX (cũng có hoạt tính) từ ticagrelor được tạo thành nhanh với t
max trung bình khoảng 2,5 giờ. Sau khi uống 90 mg ticagrelor lúc đói, nồng độ đỉnh C
max đạt 529 ng/mL và diện tích dưới đường cong AUC là 3,451 ng*h/mL. Tỷ lệ chuyển hóa là 0,28 đối với nồng độ đỉnh C
max và 0,42 đối với diện tích dưới đường cong AUC.
Sinh khả dụng tuyệt đối trung bình của ticagrelor ước lượng khoảng 36%. Tiêu thụ một bữa ăn giàu chất béo làm tăng 21% diện tích dưới đường cong AUC của ticagrelor và giảm 22% nồng độ đỉnh C
max của chất chuyển hóa có hoạt tính nhưng không ảnh hưởng đến nồng độ đỉnh C
max của ticagrelor hoặc diện tích dưới đường cong AUC của chất chuyển hóa có hoạt tính. Những sự thay đổi nhỏ này được xem là ít có ý nghĩa lâm sàng, do đó, ticagrelor có thể sử dụng cùng hoặc không cùng với thức ăn. Ticagrelor cũng như chất chuyển hóa có hoạt tính là những cơ chất của P-gp.
Ticagrelor dưới dạng viên bị nghiền rồi phân tán trong nước, được uống hoặc dùng qua ống thông dạ dày, có sinh khả dụng có thể so sánh được với dạng viên nguyên vẹn về các chỉ số AUC và C
max của ticagrelor và các chất chuyển hóa có hoạt tính. Nồng độ khởi đầu (0,5 và 1 giờ sau khi uống) của viên bị nghiền rồi phân tán trong nước cao hơn so với viên nguyên vẹn, với số liệu về nồng độ hầu như giống hệt sau đó (sau 2-48 giờ).
Phân bố
Thể tích phân bố ở trạng thái hằng định của ticagrelor là 87,5 L. Ticagrelor và chất chuyển hóa có hoạt tính liên kết cao với protein huyết tương (>99,0%).
Chuyển hóa
CYP3A4 là enzym chính chịu trách nhiệm chuyển hóa ticagrelor và hình thành nên chất chuyển hóa có hoạt tính và sự tương tác với các cơ chất khác của enzym CYP3A có thể đi từ hoạt hóa đến ức chế.
Chất chuyển hóa chính của ticagrelor là AR-C124910XX, chất này cũng có hoạt tính khi nghiên cứu
in vitro gắn kết với thụ thể P2Y
12 ADP của tiểu cầu. Thời gian và nồng độ tiếp xúc với chất chuyển hóa có hoạt tính bằng khoảng 30-40% thời gian và nồng độ tiếp xúc với ticagrelor.
Thải trừ
Đường thải trừ chính của ticagrelor thông qua chuyển hóa ở gan. Khi uống ticagrelor được đánh dấu phóng xạ, hoạt tính phóng xạ được hoàn hồi trung bình khoảng 84% (57,8% ở phân, 26,5% ở nước tiểu). Sự hoàn hồi ticagrelor và chất chuyển hóa có hoạt tính trong nước tiểu đều thấp hơn 1% so với liều dùng. Đường thải trừ chính của chất chuyển hóa có hoạt tính rất có thể qua đường mật. T
1/2 trung bình khoảng 7 giờ đối với ticagrelor và 8,5 giờ đối với chất chuyển hóa có hoạt tính.
Các nhóm dân số đặc biệt
Người cao tuổi
Quan sát thấy nồng độ và thời gian tiếp xúc với ticagrelor (khoảng 25% đối với cả C
max và AUC) và chất chuyển hóa có hoạt tính ở những bệnh nhân cao tuổi (≥ 75 tuổi) bị Hội Chứng Mạch Vành Cấp cao hơn so với nhóm bệnh nhân trẻ hơn theo phân tích dược động học trên các cá thể nghiên cứu. Sự khác biệt này không có ý nghĩa lâm sàng (xem phần
Liều lượng và Cách dùng).
Trẻ em
Ticagrelor chưa được nghiên cứu trên đối tượng trẻ em (xem phần
Liều lượng và Cách dùng và
Dược lý - Đặc tính dược lực học).
Giới tính
Quan sát thấy nồng độ và thời gian tiếp xúc với ticagrelor và chất chuyển hóa có hoạt tính ở phụ nữ cao hơn nam giới. Sự khác biệt này không có ý nghĩa lâm sàng.
Bệnh nhân suy thận
Nồng độ và thời gian tiếp xúc với ticagrelor và chất chuyển hóa có hoạt tính thấp hơn khoảng 20% và nồng độ tiếp xúc các chất chuyển hóa có hoạt tính cao hơn khoảng 17% ở những bệnh nhân bị suy thận nặng (độ thanh thải creatinin < 30 mL/phút) so với những bệnh nhân có chức năng thận bình thường (xem phần
Liều lượng và Cách dùng).
Bệnh nhân suy gan
Nồng độ đỉnh C
max và diện tích dưới đường cong AUC của ticagrelor ở những bệnh nhân suy gan nhẹ cao hơn lần lượt là 12% và 23% so với những người khỏe mạnh bình thường, tuy nhiên, tác động ức chế kết tập tiểu cầu của ticagrelor tương tự giữa hai nhóm nghiên cứu. Không cần điều chỉnh liều ở bệnh nhân suy gan nhẹ. Ticagrelor chưa được nghiên cứu trên bệnh nhân suy gan nặng và chưa có thông tin dược động học của thuốc ở bệnh nhân suy gan trung bình. Ở bệnh nhân có một hoặc nhiều xét nghiệm chức năng gan tăng trung bình hay nghiêm trọng so với mức cơ bản, nồng độ ticagrelor trong huyết tương gần mức trung bình hoặc hơi tăng nhẹ so với các đối tượng không có tăng mức cơ bản. Không cần điều chỉnh liều ở bệnh nhân suy gan trung bình (xem phần
Liều lượng và Cách dùng và
Cảnh báo và Thận trọng).
Chủng tộc
Bệnh nhân có nguồn gốc châu Á có sinh khả dụng trung bình cao hơn 39% so với nhóm bệnh nhân da trắng. Bệnh nhân da đen có sinh khả dụng của ticagrelor thấp hơn 18% so với bệnh nhân da trắng. Theo các nghiên cứu dược lý trên lâm sàng, nồng độ và thời gian tiếp xúc (C
max và AUC) của ticagrelor ở bệnh nhân Nhật Bản cao hơn khoảng 40% (20% sau khi điều chỉnh trọng lượng cơ thể) so với người da trắng. Nồng độ và thời gian tiếp xúc thuốc ở bệnh nhân tự nhận có nguồn gốc Tây Ban Nha hoặc Latinh thì cũng tương tự như ở chủng tộc da trắng.




 Đăng xuất
Đăng xuất