Mỗi mL: Globulin miễn dịch người 100 mg.
Mỗi lọ 25 mL dung dịch thuốc có chứa: 2,5 g Globulin miễn dịch người.
Mỗi lọ 50 mL dung dịch thuốc có chứa: 5 g Globulin miễn dịch người.
Tỉ lệ của các phân bố các thành phần IgG khác (giá trị tương đối):
IgG1 ≥56,9%; IgG2 ≥26,6%; IgG3 ≥3,4%; IgG4 ≥1,7%
Giá trị tối đa hàm lượng IgA đạt 140 mcg/mL.
Sản phẩm được sản xuất từ huyết tương của người hiến tặng.
Tá dược: Glycine, Nước cất pha tiêm.
Dạng bào chế: Dung dịch truyền tĩnh mạch. Dung dịch trong suốt đến trắng sữa nhẹ, từ không màu đến màu vàng nhạt.
Đặc tính dược lực học
Nhóm dược lý lâm sàng: huyết thanh miễn dịch và globulin miễn dịch, dùng cho đường truyền trong mạch. Mã ATC: J06BA02.
Globulin miễn dịch của người bình thường có chứa chủ yếu là IgG với phổ kháng thể rộng chống lại các tác nhân nhiễm khuẩn.
Globulin miễn dịch ở người bình thường khỏe mạnh có chứa kháng thể IgG tồn tại ở mức nồng độ bình thường. Chế phẩm được bào chế từ trộn huyết tương tươi của không ít hơn 1000 người hiến tặng. Sự phân bố của các phân nhóm IgG gần với tỉ lệ phân bố tự nhiên trong máu người. Mức liều điều trị thích hợp của chế phẩm có thể phục hồi nồng độ IgG từ mức thấp trở về mức nồng độ thông thường.
Cơ chế tác động trong các chỉ định điều trị ngoài chỉ định dùng trong liệu pháp thay thế hiện vẫn chưa được làm sáng tỏ, nhưng các tác động điều chỉnh miễn dịch đã được ghi nhận.
Đặc tính dược động học
Globulin miễn dịch của người bình thường đạt sinh khả dụng tức thì và hoàn toàn trong tuần hoàn máu của người nhận sau khi truyền qua đường tĩnh mạch. Các globulin miễn dịch được phân bố gần như nhanh chóng hoàn toàn giữa máu và thể dịch, sau khoảng từ 3-5 ngày sẽ đạt được cân bằng giữa các khoang trong và ngoài mạch.
Các thông số dược động học của KIOVIG được xác định trong hai thử nghiệm lâm sàng trên bệnh nhân thiếu hụt globulin miễn dịch nguyên phát tại Châu Âu và Mỹ. Trong các nghiên cứu này, tổng số 83 đối tượng nghiên cứu có độ tuổi ít nhất là 2 tuổi, được điều trị với mức liều từ 300-600 mg/kg thể trọng trong vòng 21-28 ngày trong suốt 6-12 tháng. Thời gian nửa đời bán thải trung bình của IgG sau khi điều trị với KIOVIG là 32,5 ngày. Thời gian bán thải này có thể khác nhau trên từng bệnh nhân, đặc biệt trong tình trạng thiếu hụt miễn dịch nguyên phát. Các thông số dược động học của chế phẩm được tóm tắt ở bảng sau đây, tất cả các thông số này đều được phân tích độc lập trên 3 nhóm nghiên cứu: trẻ dưới 12 tuổi (n=5), thanh thiếu niên (13-17 tuổi, n=10), và người trưởng thành (trên 18 tuổi, n=64). Giá trị thu được trong các nghiên cứu này được so sánh với các thông số đã được ghi nhận của các thành phần globulin miễn dịch tự nhiên khác.
- xem Bảng 1.
 Dữ liệu tiền lâm sàng
Dữ liệu tiền lâm sàng
Globulin miễn dịch là các thành phần tự nhiên của cơ thể.
Tính an toàn của KIOVIG đã được minh chứng trong một số nghiên cứu cận lâm sàng. Các dữ liệu nghiên cứu cận lâm sàng cho thấy không có nguy cơ đặc biệt nào trên người bệnh dựa trên các nghiên cứu an toàn dược động học và nghiên cứu độc tính.
Nghiên cứu độc tính liều lặp lại, nghiên cứu độc tính trên gen và độc tính trên khả năng sinh sản không thể tiến hành do bị tác động và ảnh hưởng bởi nhiều protein khác loài. Do kinh nghiệm sử dụng thuốc trên lâm sàng cho thấy không có bằng chứng nào về nguy cơ gây ung thư do các globulin miễn dịch, không có thử nghiệm về các chủng khác loài nào được tiến hành.
Dùng trong liệu pháp điều trị thay thế ở người trưởng thành, trẻ nhỏ và thanh thiếu niên (từ 0-18 tuổi) trong các trường hợp:
• Các hội chứng biểu hiện thiếu hụt miễn dịch nguyên phát có kèm suy giảm sản xuất kháng thể
• Giảm gamma-globulin miễn dịch trong máu và nhiễm khuẩn tái phát ở các bệnh nhân thiếu lympho máu bẩm sinh mà đã thất bại khi điều trị dự phòng với kháng sinh.
• Giảm gamma-globulin máu và nhiễm khuẩn tái diễn trên bệnh nhân u đa tủy ở pha ổn định đã không còn đáp ứng với phương pháp chủng ngừa phế cầu khuẩn.
• Giảm gamma-globulin trên bệnh nhân sau ghép tế bào gốc cơ quan tạo máu đồng loại dị gen (HSCT).
• Trẻ bị AIDS bẩm sinh và nhiễm khuẩn tái diễn.
Điều chỉnh miễn dịch ở người trưởng thành, trẻ nhỏ và thanh thiếu niên (từ 0-18 tuổi) trong các trường hợp:
1. Xuất huyết giảm tiểu cầu nguyên phát (ITP) trên bệnh nhân có nguy cơ chảy máu cao hoặc trước khi phẫu thuật để điều chỉnh số lượng tiểu cầu.
2. Hội chứng Guillain Barré.
3. Bệnh Kawasaki.
4. Bệnh thần kinh vận động đa ổ.
Liệu pháp thay thế cần được khởi đầu điều trị và giám sát chặt chẽ bởi chuyên viên y tế có kinh nghiệm trong điều trị các suy giảm miễn dịch.
Liều dùng
Liều dùng và liều trị liệu phụ thuộc từng chỉ định.
Trong liệu pháp thay thế trong suy giảm miễn dịch, liều dùng cần được điều chỉnh phù hợp từng cá thể dựa trên các đáp ứng dược động học và lâm sàng.
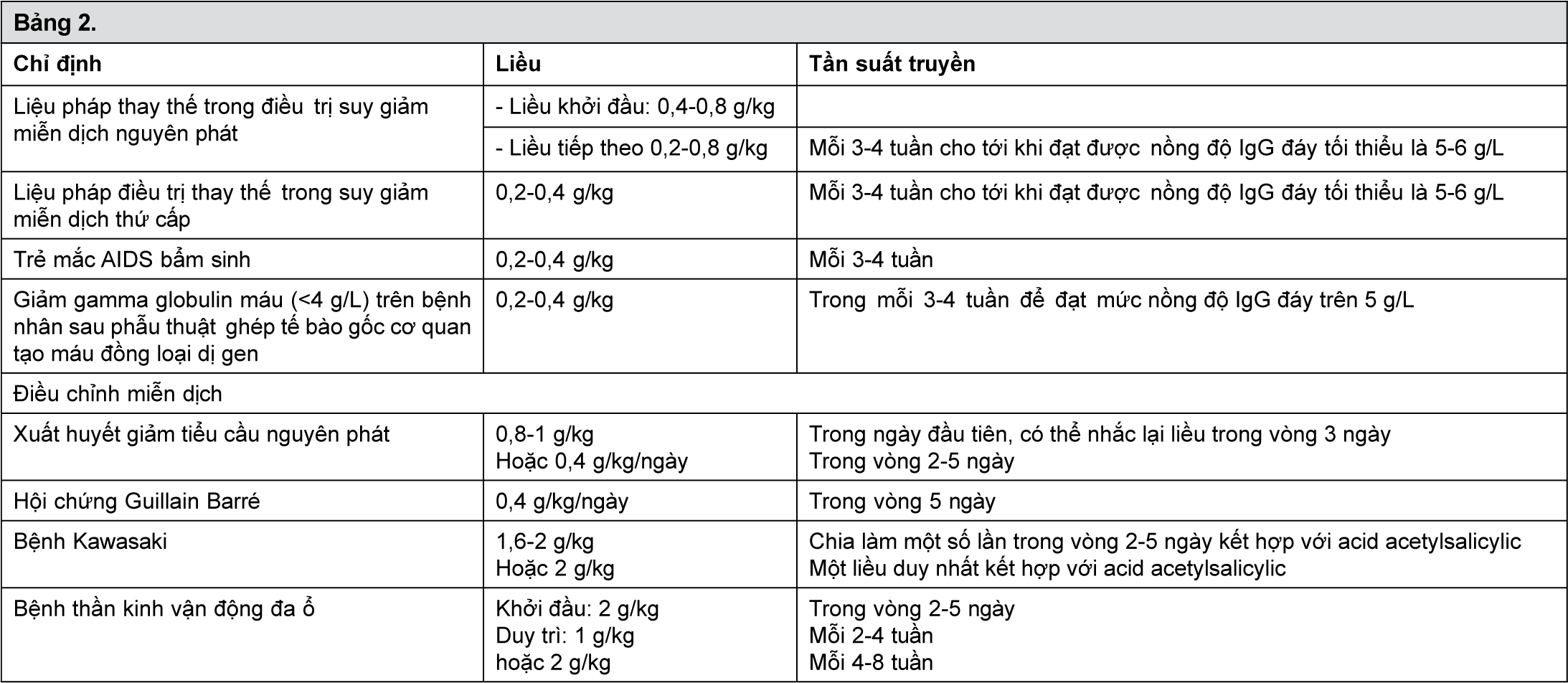
Có thể áp dụng mức liều sau được tóm tắt trong bảng sau như một chỉ dẫn khuyến cáo:
- xem Bảng 2.
 Điều trị trên trẻ nhỏ
Điều trị trên trẻ nhỏ
Liều dùng trên trẻ nhỏ và thanh thiếu niên (0-18 tuổi) là không khác so với liều chỉ định trên người lớn do mỗi mức liều được chỉ định dựa trên kg thể trọng và điều chỉnh dựa trên kết quả lâm sàng thu được trong điều kiện nói trên.
Tốc độ truyền thuốc
Khuyến cáo bắt đầu điều trị ở mức liều 0,5 mL/kg thể trọng/giờ. Nếu truyền thuốc ở tốc độ khuyến cáo, và mức hàm lượng đó không gây áp lực lên người bệnh, có thể tăng dần tốc độ truyền. Tốc độ truyền tối đa là 6 mL/kg/giờ. Tốc độ truyền thuốc được điều chỉnh cụ thể trên từng bệnh nhân, phụ thuộc vào mức độ dung nạp thuốc của họ.
Ở bệnh nhân có nguy cơ suy thận cấp hoặc nguy cơ có các tác dụng huyết khối ngoại ý, không truyền dịch ở mức tốc độ tối đa. Nhìn chung, nên khởi đầu điều trị với mức liều tối thiểu cho các bệnh nhân lần đầu điều trị với KIOVIG, hoặc được chuyển từ một dung dịch globulin miễn dịch khác sang KIOVIG, sau đó có thể tăng tốc độ truyền từ từ lên tối đa nếu người bệnh có thể dung nạp tốt sau vài lần truyền ở tốc độ trung bình.
Một số tác dụng ngoại ý như đau đầu, bốc hỏa có thể liên quan tới tốc độ truyền dịch. Giảm tốc độ truyền hoặc ngưng truyền dịch có thể làm các tác dụng ngoại ý này biến mất nhanh chóng. Tốc độ truyền dịch sau đó nên duy trì ở mức tránh làm tái phát các tác dụng không mong muốn trên.
Các tác dụng ngoại ý có thể xảy ra thường xuyên hơn trên các bệnh nhân suy giảm miễn dịch, trên bệnh nhân được truyền globulin miễn dịch đường tĩnh mạch lần đầu, hay khi được chuyển từ chế phẩm thương mại khác sang KIOVIG, hoặc khi được truyền lại giữa các khoảng cách quá lâu.
Cách dùng
Dùng thuốc theo đường tĩnh mạch.
Nếu cần thiết phải pha loãng dịch thuốc trước khi truyền, chỉ nên pha KIOVIG với dung dịch glucose 5% để đạt được mức nồng độ cuối là 50 mg/mL (5% globulin miễn dịch). Xem hướng dẫn cách pha thuốc trước khi truyền.
Mẫn cảm với bất cứ thành phần nào của thuốc hoặc các tá dược của thuốc.
Mẫn cảm với các globulin miễn dịch của người, các bệnh nhân có sẵn kháng thể phản vệ hoặc có phản ứng quá mẫn nghiêm trọng với Globulin miễn dịch tự nhiên.
Bệnh nhân thiếu hụt IgA nghiêm trọng (IgA < 0,05 g/L) có thể phát triển kháng thể kháng IgA dẫn đến phản ứng quá mẫn nghiêm trọng, tình trạng mẫn cảm đã được ghi nhận khi bệnh nhân sử dụng globulin miễn dịch đường tĩnh mạch kể cả khi bản thân các globulin có chứa hàm lượng IgA vào khoảng 37 mcg/mL.
Cảnh báo
Quá mẫn
Các chế phẩm globulin miễn dịch người hiếm khi gây ra phản ứng kiểu phản vệ như tụt huyết áp, thậm chí trên cả các bệnh nhân đã dung nạp tốt với việc truyền globulin miễn dịch trước đó. Bệnh nhân có kháng thể kháng IgA hoặc thiếu hụt IgA là một yếu tố của các bệnh lý suy giảm miễn dịch, nếu được chỉ định các chế phẩm globulin miễn dịch sẽ có nguy cơ tăng các phản ứng phản vệ.
Thận trọng
Huyết khối
Nguy cơ huyết khối và huyết khối tiểu cầu đã được báo cáo là có liên quan tới việc điều trị với các globulin miễn dịch (bao gồm cả điều trị đường tĩnh mạch) như:
• loạn nhịp,
• tai biến mạch máu não (bao gồm sốc đột quỵ),
• phù phổi, và
• viêm tắc tĩnh mạch huyết khối sâu.
Cần đảm bảo bù đủ nước cho bệnh nhân trước khi dùng thuốc. Theo dõi dấu hiệu, triệu chứng huyết khối và đánh giá độ nhớt của máu ở các bệnh nhân có nguy cơ độ nhớt của máu cao.
Biến chứng về thận
Một số tác dụng ngoại ý trên thận đã được báo cáo trên các bệnh nhân truyền globulin miễn dịch đường tĩnh mạch, đặc biệt là với các chế phẩm có chứa đường sucrose (KIOVIG không chứa đường sucrose), bao gồm cả trường hợp
• suy thận cấp,
• hoại tử ống thận cấp tính,
• hoại tử tế bào biểu mô ống thận gần, và
• thận hư do thẩm thấu.
Trong hầu hết ở các trường hợp, các yếu tố nguy cơ được xác định như tiền sử suy giảm chức năng thận, tiểu đường, giảm thể tích, thừa cân, điều trị phối hợp với các thuốc gây độc thận hoặc ở người bệnh trên 65 tuổi, nhiễm trùng máu, độ nhớt của máu cao hay paraprotein máu.
Trong trường hợp suy giảm chức năng thận, cần xem xét khả năng dừng điều trị với globulin miễn dịch theo đường tĩnh mạch. Trong khi các báo cáo về tác dụng gây rối loạn chức năng thận và suy thận cấp được xem là có liên quan tới việc sử dụng các sản phẩm globulin miễn dịch đường tĩnh mạch đã được cấp số đăng ký, người ta nhận thấy các tác dụng phụ ghi nhận trên các chế phẩm có sử dụng sucrose làm chất ổn định góp một tỷ lệ không nhỏ trên tổng số trường hợp báo cáo. Ở các bệnh nhân có nguy cơ cao, có thể xem xét thêm việc dùng các chế phẩm không chứa đường sucrose.
Ở các bệnh nhân có nguy cơ suy thận cấp, cần truyền các thuốc chứa globulin miễn dịch với tốc độ truyền tối thiểu với liều khuyến cáo mang tính thực tiễn.
Tổn thương cấp ở phổi có liên quan đến truyền thuốc (Transfusion Related Acute Lung Injury - TRALI)
Đã có báo cáo về trường hợp phù phổi không phải do nguyên nhân ở tim (tổn thương phổi cấp liên quan đến truyền dịch) trên bệnh nhân điều trị với các chế phẩm globulin miễn dịch, trong đó có KIOVIG.
Hội chứng viêm màng não vô trùng
Đã có báo cáo về hội chứng viêm màng não vô trùng xảy ra có liên quan tới việc điều trị với các chế phẩm globulin miễn dịch đường tĩnh mạch và đường dưới da. Dừng điều trị với các chế phẩm globulin miễn dịch có thể làm giảm hội chứng viêm màng não trong vài ngày mà không để lại biến chứng. Hội chứng này thường xuất hiện trong vài giờ cho đến 2 ngày sau khi điều trị.
• Phân tích dịch não tủy thường cho kết quả dương tính với tăng lympho bào lên tới vài nghìn tế bào/mm3, chủ yếu là các tế bào bạch cầu hạt, và nồng độ protein lên tới vài trăm mg/dL.
• Viêm màng não vô trùng cấp có thể xuất hiện nhiều hơn ở bệnh nhân nữ.
Tan huyết
Các chế phẩm globulin miễn dịch có thể chứa các kháng thể trong máu mà có thể đóng vai trò như các tan huyết tố và sinh ra trong nghiên cứu in vivo lớp áo bao phủ các tế bào hồng cầu với các globulin miễn dịch, tạo ra phản ứng dương tính trực tiếp với kháng thể globulin (Thử nghiệm Coombs), và rất hiếm khi, gây ra tan huyết. Tình trạng tan huyết có thể gây ảnh hướng tới liệu pháp điều trị globulin miễn dịch đường tĩnh mạch do sự tăng các mảnh tế bào hồng cầu.
Tăng protein máu
Tình trạng tăng protein máu và tăng độ nhớt của huyết thanh có thể xảy ra sau khi điều trị với các globulin miễn dịch. Ngoài ra, tình trạng giảm natri máu cũng có thể được ghi nhận là liên quan tới việc điều trị với các globulin miễn dịch.
Các tác nhân truyền nhiễm
KIOVIG là chế phẩm từ huyết thanh người, do đó thuốc có thể gây nguy cơ truyền các tác nhân gây bệnh, ví dụ vi rút, điều này cũng đúng cả với tác nhân gây bệnh bò điên, do đó về lý thuyết có thể phát sinh bệnh bò điên cổ điển. Điều này cũng đúng với các vi rút chưa biết hay các tác nhân gây bệnh mới. Hiện vẫn chưa có ca nào chứng minh được là có liên quan tới chế phẩm KIOVIG.
Các biện pháp phòng ngừa các tác nhân nhiễm khuẩn chuẩn quy có nguy cơ gặp phải khi sử dụng các chế phẩm được bào chế từ máu hoặc huyết tương người bao gồm sàng lọc người cho, sàng lọc các cá thể người hiến tặng, trộn huyết tương tươi kèm chất đánh dấu chuyên biệt với từng loại nhiễm khuẩn, đồng thời áp dụng các biện pháp bất hoạt hoặc loại trừ vi rút trong công đoạn sản xuất. Mặc dù vậy, vẫn không thể loại trừ hoàn toàn nguy cơ nhiễm các tác nhân gây bệnh khi điều trị với các chế phẩm từ máu và huyết thanh người.
Các biện pháp kể trên có hiệu quả trong việc loại trừ các chủng vi rút có vỏ bọc như HIV, HBV và HCV, cũng như một số chủng vi rút không vỏ bọc HAV và parvo vi rút B19.
Điều này khẳng định các kinh nghiệm trên lâm sàng khi thiếu vắng sự truyền nhiễm của các vi rút viêm gan A hoặc parvo vi rút B19 trong điều trị với các globulin miễn dịch, cũng như giả thiết rằng một số thành phần kháng thể đóng vai trò quan trọng cho sự an toàn đối với vi rút gây bệnh.
Khuyến cáo mỗi khi sử dụng KIOVIG cho người bệnh, cần quản lý các thông tin: tên bệnh nhân, số lô của sản phẩm được ghi lại để duy trì một liên kết giữa các bệnh nhân và các sản phẩm.
Ảnh hưởng đến kết quả xét nghiệm
Sau khi truyền globulin miễn dịch, sự tăng tạm thời các kháng thể khác nhau được vận chuyển thụ động trong máu bệnh nhân có thể gây ra kết quả dương tính giả trong một số xét nghiệm huyết thanh, ví dụ Viêm gan A, viêm gan B, sởi, và thủy đậu. Sự vận chuyển các kháng thể đến các kháng nguyên hồng cầu, ví dụ như A, B, D, có thể gây nhiễu một số xét nghiệm huyết thanh đối với các kháng thể tế bào máu, ví dụ như xét nghiệm kháng globulin (thử nghiệm Coombs).
Dùng globlin miễn dịch có thể dẫn đến kết quả dương tính giả trong các định lượng phụ thuốc vào việc phát hiện beta-D-glucan để chẩn đoán tình trạng nhiễm nấm. Tình trạng này có thể kéo dài vài tuần sau khi truyền thuốc.
Ảnh hưởng lên khả năng lái xe và vận hành máy móc
Khả năng lái xe và vận hành máy móc có thể bị ảnh hưởng bởi một số tác dụng bất lợi có liên quan tới KIOVIG. Bệnh nhân đã từng có tác dụng ngoại ý trong khi điều trị cần đợi đến khi hết các tác dụng bất lợi mới được tiếp tục vận hành máy móc, tàu xe.
Phụ nữ có thai và đang cho con bú
Độ an toàn của chế phẩm này trên phụ nữ có thai hiện chưa được thiết lập, do đó thận trọng khi chỉ định các chế phẩm này trên phụ nữ có thai và cho con bú.
Ảnh hưởng lên khả năng sinh sản
Kinh nghiệm trên lâm sàng khi điều trị với các globulin miễn dịch cho thấy không có ảnh hưởng lên khả năng sinh sản.
Sau khi truyền globulin miễn dịch, các kháng thể khác nhau được tăng lên thụ động tạm thời trong máu người bệnh có thể gây hiện tượng dương tính giả trong các xét nghiệm huyết học ví dụ vi rút viêm gan A, viêm gan B, vi rút sởi, thủy đậu. Chủ động truyền các kháng thể với kháng nguyên hồng cầu như kháng nguyên A, B, C, có thể gây ảnh hưởng tới một vài xét nghiệm huyết thanh về các kháng thể hồng cầu, ví dụ xét nghiệm xác định các kháng globulin (DAT, thử nghiệm Coombs trực tiếp).
Việc điều trị với các globulin miễn dịch có thể gây ảnh hưởng trong một giai đoạn tối thiểu là 6 tuần tới 3 tháng lên hiệu quả của các vaccine vi rút sống giảm độc như sởi, rubella, quai bị và thủy đậu.
Pha loãng KIOVIG với dung dịch glucose 5% có thể làm tăng đường máu.
Không nên trộn lẫn thuốc này với các thuốc khác ngoại trừ các sản phẩm được nêu ở mục Hướng dẫn pha thuốc. Không dùng nước muối sinh lý làm dung môi pha loãng thuốc.
Tác dụng không mong muốn trong các thử nghiệm lâm sàng
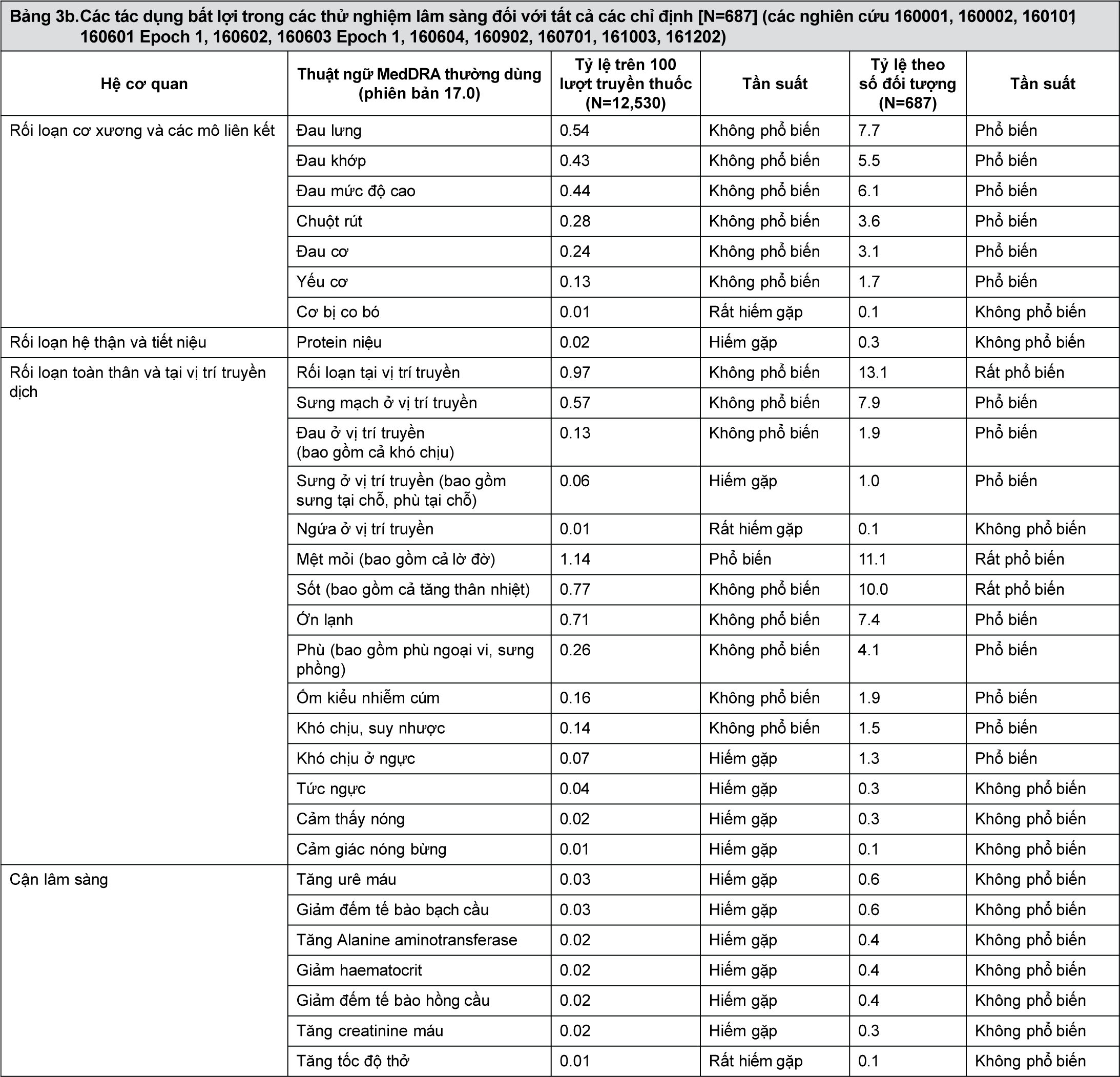
Các tác dụng bất lợi trong các thử nghiệm lâm sàng đối với globulin miễn dịch (các nghiên cứu 160001, 160002, 160101, 160601 Epoch 1, 160602, 160603 Epoch 1, 160604, 160902, 160701, 161003, 161202) được nêu trong bảng 3.
Tần suất các tác dụng bất lợi được đánh giá theo tỷ lệ sau: rất phổ biến (≥1/10); phổ biến (≥1/100 đến <1/10); không phổ biến (≥1/1,000 đến <1/100); hiếm gặp (≥1/10,000 đến <1/1,000); rất hiếm (<1/10,000); không rõ (có thể không ước lượng được từ các dữ liệu sẵn có).
Tỷ lệ trên 100 lượt truyền thuốc được tính bằng số trường hợp tác dụng bất lợi chia cho tổng số lượt truyền thuốc rồi nhân với 100.
- xem Bảng 3a và 3b.

 Các tác dụng bất lợi trong quá trình lưu hành thuốc
Các tác dụng bất lợi trong quá trình lưu hành thuốc
Bên cạnh các tác dụng bất lợi được báo cáo trong các thử nghiệm lâm sàng, các tác dụng bất lợi sau đây được ghi nhận trong quá trình lưu hành thuốc và được liệt kê dựa trên thứ tự Hệ cơ quan trong cơ thể, sắp xếp theo mức độ trầm trọng của phản ứng.
Rối loạn hệ máu và hạch bạch huyết: Tan huyết.
Rối loạn hệ miễn dịch: Phản ứng sốc phản vệ.
Rối loạn hệ thần kinh trung ương: Tai biến mạch máu não, nhồi máu cơ tim thoáng qua, rùng mình.
Rối loạn tim: Nhồi máu cơ tim.
Rối loạn mạch: Viêm tĩnh mạch huyết khối, hạ huyết áp.
Rối loạn hệ hô hấp, ngực và trung thất: Tắc mạch phổi, phù phổi.
Rối loạn da và hệ dưới da: Tăng tiết mồ hôi.
Rối loạn toàn thần và vị trí truyền thuốc: Đau ngực.
Cận lâm sàng: Dương tính với thử nghiệm Coombs trực tiếp, giảm oxy bão hòa.
Các chấn thương, ngộ độc và các biến chứng liên quan đến thao tác truyền: Suy phổi liên quan đến truyền dịch.
Quá liều có thể dẫn đến thừa dịch trong cơ thể, tăng huyết áp, đặc biệt trên các bệnh nhân có nhiều yếu tố nguy cơ gồm các bệnh nhân cao tuổi, bệnh nhân có tổn thương tim và thận.
Hướng dẫn xử lý và pha chế thuốc
Cần làm ấm thuốc lên tới nhiệt độ cơ thể hoặc nhiệt độ phòng trước khi sử dụng.
Để thu được dung dịch globulin miễn dịch 50 mg/mL (5%), cần pha loãng dung dịch thuốc KIOVIG 100 mg/mL (10%) với một lượng thể tích tương ứng của dung dịch glucose. Khuyến cáo cần giảm thiểu tối đa nguy cơ nhiễm khuẩn trong quá trình pha loãng thuốc.
Cần kiểm tra cảm quan dung dịch thuốc để tránh tiểu phân và đổi màu dung dịch trước khi truyền dịch. Dung dịch trước khi truyền thuốc phải đảm bảo trong suốt hoặc có màu trắng đục nhẹ. Không được sử dụng các dung dịch thuốc có kết tủa hoặc chuyển sang vẩn đục.
Các dung dịch thuốc thừa, thuốc không sử dụng cần phải được hủy bỏ theo quy chế xử lý chất thải y tế tại địa phương.
Bảo quản thuốc ở nhiệt độ 2°C – 8°C. Không để đông lạnh. Tránh ánh sáng.
Nếu cần thiết phải pha loãng dung dịch, cần sử dụng ngay sau khi pha loãng.
Nghiên cứu về độ ổn định trong khi sử dụng của KIOVIG sau khi pha loãng đã được tiến hành với dung môi glucose 5% đến nồng độ pha loãng cuối là 50 mg/mL (5%) globulin miễn dịch đã chứng minh rằng dung dịch pha loãng ổn định ở 21 ngày ở nhiệt độ từ 2°C - 8°C cũng như ở nhiệt độ 28°C - 30°C; tuy nhiên, các nghiên cứu này đã không xem xét đồng thời cả yếu tố lây nhiễm vi sinh và tính an toàn.
Hạn dùng: 2 năm.
J06BA02 - immunoglobulins, normal human, for intravascular adm. ; Belongs to the class of normal human immunoglobulins. Used in passive immunizations.
Kiovig Dung dịch truyền tĩnh mạch 100 mg/mL
25 mL x 1's;50 mL x 1's




 Đăng xuất
Đăng xuất







